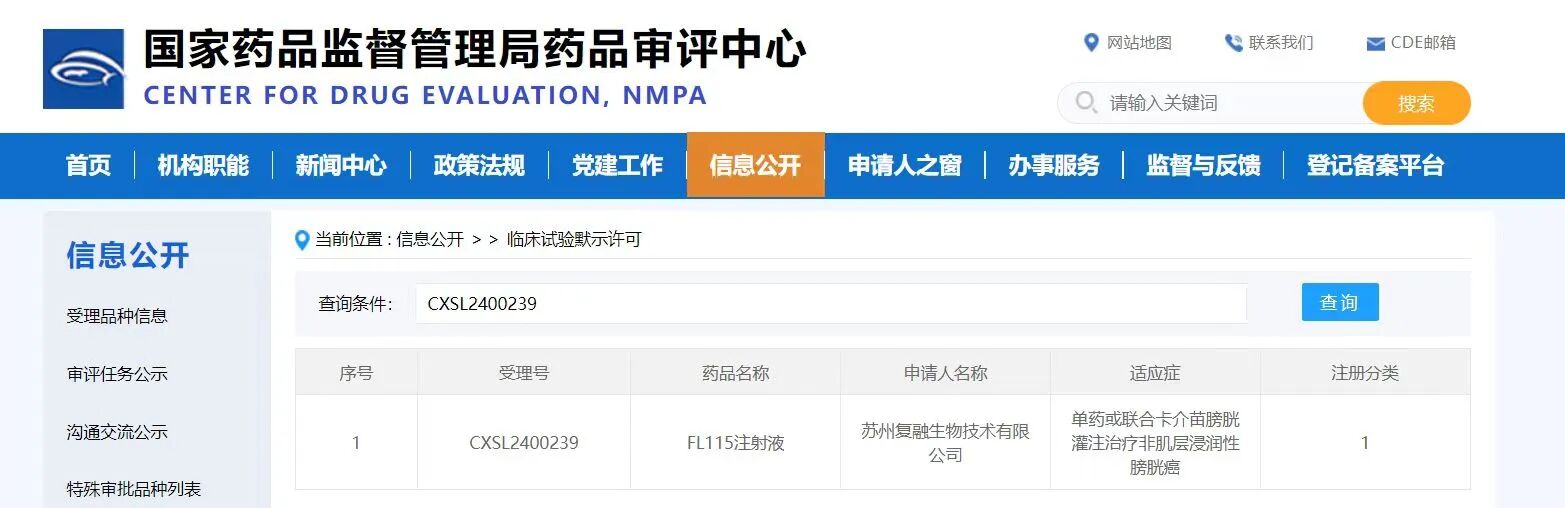
2024年6月23日,中国苏州高新区,基于合成免疫的细胞因子药物领军企业苏州复融生物技术有限公司宣布公司已收到国家药品监督管理局(NMPA)批准公司自主研发的新一代长效化IL-15超级免疫激动剂(FL115),其针对非肌层浸润性膀胱癌的新适应症,成功获得CDE临床试验默示许可(受理号:CXSL2400239)。这是复融生物年内获得的第二个IND批件,彰显了复融团队卓越的研发实力和高效的执行能力。
FL115是一款长效单臂的IL-15超级免疫激动剂,在分子设计上,复融生物首创性地利用Fc单体延长IL-15的半衰期,单臂设计在保持药物有效性不变的情况下,有效避免了细胞因子的毒性问题(细胞因子风暴、Fc效应功能等),这使得FL115的给药剂量达到前所未有的水平,展现出良好的安全性,突破细胞因子疗法的安全性顾虑。且具有分子量小、实体瘤穿透能力强、生产工艺简单稳健等多重优势,展现出了优质的成药性(抗体类似的产量和低免疫原性)。
值得注意的是,FL115正在美国进行用于晚期局部不可切除或转移性实体瘤治疗的I期临床研究(NCT06130722),静脉注射的给药剂量已经达到30μg/kg,展现出了卓越的安全性。细胞因子的安全性问题是困扰其成药性的最大难点,FL115率先取得了突破性的进展,给到了同类上市药物Anktiva的静脉注射最高剂量的3倍。FL115有望极大地拓展治疗窗,成为继PD-1单抗之后的抗肿瘤重磅炸弹药物。
复融生物联合创始人、董事长纪恩表示:“这几个月来我们取得了很多令人兴奋的成果,FL115在临床上展示出了优质的安全性,这为未来适应症的拓展奠定了坚实的基础。诸多的临床和临床前数据支持FL115具有best-in-class的潜力,我们将不断探索适应症,发挥FL115的广谱抗癌作用,为不同类型的肿瘤患者带来新的治疗方案。”



 苏公网安备32050502011888号
苏公网安备32050502011888号